Direkte Modulation von Rab-GTPase-Effektor-Wechselwirkungen
31-Jan-2014
Angewandte Chemie, 2014, DOI: 10.1002/ange.201308568, published on 31.01.2014
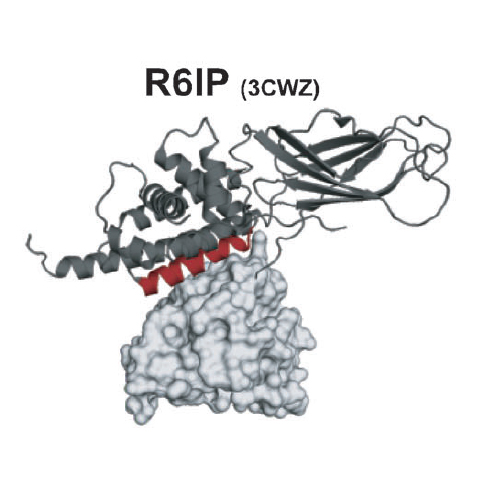
Kleine GTPasen fungieren als molekulare Schalter bei der Kontrolle zahlreicher essenzieller zellulärer Prozesse. Während eine fehlerhafte Funktion oder Regulierung von GTPasen in einer Vielzahl von humanen Erkrankungen eine wichtige Rolle spielt, hat es sich als schwierig erwiesen, diese Proteinklasse direkt zu adressieren, da ihre Regulierung und biologische Wirkung über ausgedehnte und gering profilierte Proteinoberflächen vermittelt werden. Hier beschreiben wir die Entwicklung von Inhibitoren für Protein-Protein-Wechselwirkungen von Rab-GTPasen, die eine Schlüsselrolle bei der Regulation vesikulärer Transportprozesse spielen. Auf der Basis von Kristallstrukturen von Rab-Proteinen gebunden an ihre Wechselwirkungspartner wurden so genannte “stapled peptides” entwickelt. Diese Peptide zeichnen sich durch signifikant gesteigerte Affinitäten aus. Eines der modifizierten Peptide, StRIP3, bindet selektiv an aktives Rab8a und inhibiert eine Rab8a-Effektor-Wechselwirkung in vitro.